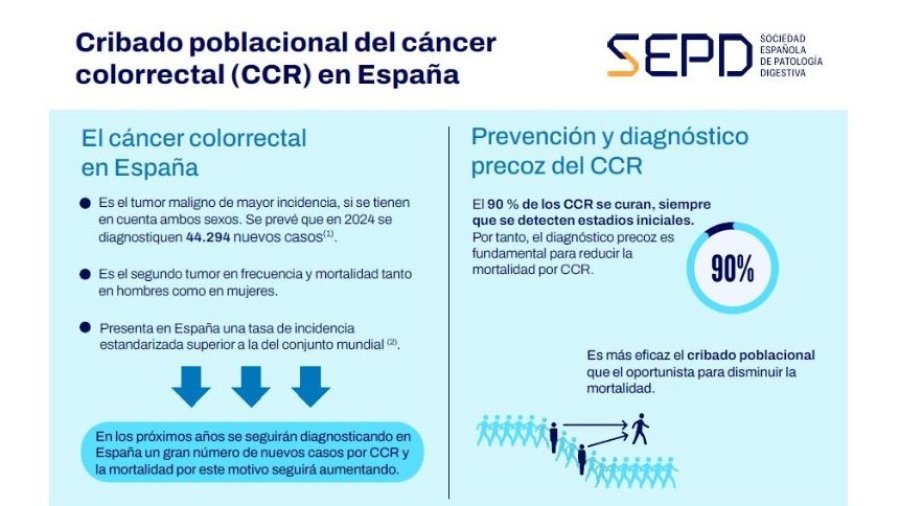
Aemice elabora una guía que promueve un entorno laboral más inclusivo para las personas con migraña
El 62 % de estos pacientes se sienten estigmatizados en el trabajo y piden más apoyo a empresas y trabajadores.
Farmacia
El COFB reelige a Jordi Casas como presidente
Es la primera vez que su junta de gobierno cuenta con el voto electrónico.
I+D
Más del 50 % de los pacientes españoles que sufren una cefalea crónica padecen migraña
Un 4 % de la población española padece dolor de cabeza más de 15 días al mes.
Política sanitaria
El FEP celebra el 8.º Encuentro Nacional de Pacientes
Las autoridades de la UE se hacen eco de las demandas del Foro Español de Pacientes.
Nace la Fundación Vivir Dos Veces para ayudar a personas con daño cerebral adquirido
Lo + leido
- 1
El papel de las enfermeras en el uso de los medicamentos biosimilares
- 2
5 Beneficios que aporta el treonato de magnesio a nuestro organismo
- 3
AseBio empareja de nuevo a mujeres profesionales y estudiantes del sector biotecnológico español
- 4
La importancia de incorporar el enfoque de Atención Centrada en la Persona (ACP) en las residencias de mayores
- 5
EIT Health financia con 1,5 millones de euros el proyecto Assist de Idoven para el diagnóstico temprano del infarto
Lo + visto
Economía
Política sanitaria
La AEP vela por una pediatría de Atención Primaria de calidad

12/04/2024
Tecnología
Fujifilm Healthcare presenta un nuevo mamógrafo digital en el Congreso Europeo de Radiología

06/03/2024
Industria
Farmacia
Hospitales
El Hospital Universitario del Henares organiza un nuevo encuentro del Consejo de Pacientes
19/03/2024
La Asociación Española de Cirujanos convoca sus becas para proyectos de investigación

12/03/2024
Legislación
Opinión
Aumentan los casos multirresistentes de tuberculosis, el reto es mejorar el diagnóstico en la población inmigrante

24/03/2024
I+D
El Imibic y Farmaindustria impulsan la investigación clínica en Atención Primaria

09/04/2024
Entrevistas
RSC
Tres de cada cuatro personas con hemofilia en España creen que llevan una vida saludable

17/04/2024






 (2).jpg)