Industria3 de febrero, 2026
Sandoz lanza Rivaroxabán en España, ampliando las opciones de tratamiento antitrombótico de alta calidad
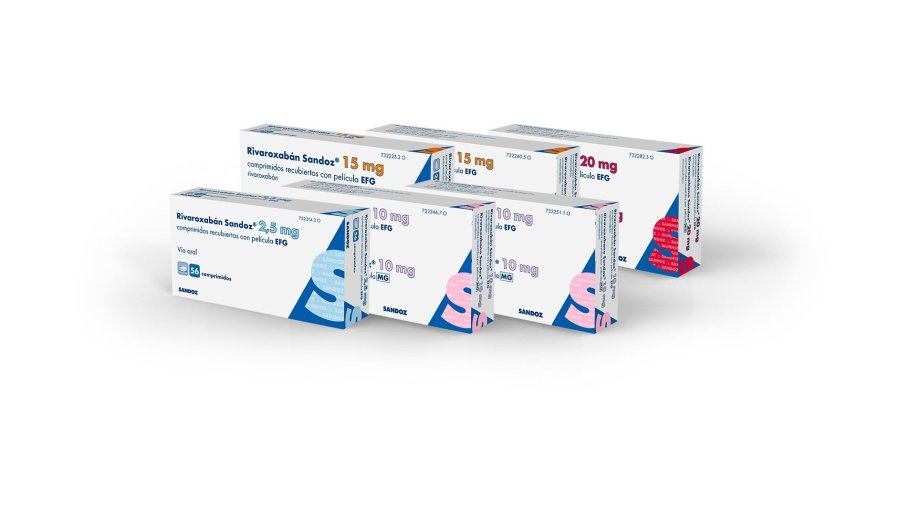 Rivaroxabán Sandoz
Rivaroxabán Sandoz
Un anticoagulante oral con amplio respaldo clínico y uso consolidado en práctica real
NOTICIAS RELACIONADAS
Sandoz, compañía líder mundial en medicamentos genéricos y biosimilares, anuncia el lanzamiento en España de Rivaroxabán Sandoz, un anticoagulante oral de acción directa indicado en distintas situaciones clínicas para el manejo y la prevención de eventos tromboembólicos, de acuerdo con su ficha técnica1,
Rivaroxabán es uno de los anticoagulantes orales de acción directa con mayor utilización en el entorno clínico2, respaldado por una amplia experiencia tanto en ensayos clínicos como en práctica clínica habitual3. El medicamento actúa como inhibidor directo y altamente selectivo del factor Xa, interrumpiendo la cascada de la coagulación y reduciendo la formación de trombina y trombos, tal y como se describe en su ficha técnica1,4.
Rivaroxabán Sandoz comprimidos EFG está indicado en adultos, entre otras situaciones clínicas, para la prevención del ictus y de la embolia sistémica en pacientes con fibrilación auricular no valvular, así como para el tratamiento de la trombosis venosa profunda (TVP), la embolia pulmonar (EP) y la prevención de sus recurrencias1. Además, la dosis de 15 mg/20 mg presenta indicación para pacientes pediátricos en tratamiento del tromboembolismo venoso (TEV) y prevención de las recurrencias del TEV en niños y adolescentes menores de 18 años1 Tanto la indicación de 15mg como la de 20mg tienen indicación pediátrica según FT.
El medicamento está disponible en distintas dosificaciones (2,5 mg5, 10 mg6, 15 mg1 y 20 mg1), lo que permite una adaptación individualizada de la pauta terapéutica según la indicación, la fase del tratamiento y las características clínicas del paciente. Además, su administración por vía oral y en pauta de una o dos tomas diarias, según indicación, facilita su uso en la práctica clínica habitual1. Rivaroxabán Sandoz comprimidos EFG es además bioaparente al medicamento de referencia7.
Con este lanzamiento, Sandoz continúa ampliando su portafolio en el área cardiovascular y reafirma su propósito de ser pioneros en facilitar el acceso a la salud de los pacientes, contribuyendo a la sostenibilidad del sistema sanitario y apoyando a los profesionales sanitarios en la toma de decisiones terapéuticas.
----------
1 Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Último acceso: enero 2026] Ficha técnica de Rivaroxabán SANDOZ 15mg/20 mg comprimidos recubiertos con película EFG. Centro de Información Online de Medicamentos (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/p/86414/P_86414.html
2 Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). European Heart Journal. 2021;42(5):373–498. doi:10.1093/eurheartj/ehaa612. Disponible en: Oxford Academic | PDF
3 European Medicines Agency (EMA). Xarelto (rivaroxaban): EPAR – Medicine overdview. https://www.ema.europa.eu/en/medicines/human/EPAR/xarelto
4 European Medicines Agency (EMA). Xarelto: Summary of Product Characteristics – Pharmacodynamic properties (Mechanism of action). https://www.ema.europa.eu/en/documents/product-information/xarelto-epar-product-information_en.pdf
5 Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Último acceso: enero 2026] Ficha técnica de Rivaroxabán SANDOZ 2,5mg comprimidos recubiertos con película EFG. Centro de Información Online de Medicamentos (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/p/86415/P_86415.html
6 Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Último acceso: enero 2026] Ficha técnica de Rivaroxabán SANDOZ 10mg comprimidos recubiertos con película EFG. Centro de Información Online de Medicamentos (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/p/86408/P_86408.html
7 European Medicines Agency (EMA). Rivaroxaban film-coated tablets 2.5, 10, 15 and 20 mg – Product-specific bioequivalence guidance. Reference: EMA/188384/2025/Rev.1. Effective date: 1 January 2026. https://www.ema.europa.eu/en/rivaroxaban-product-specific-bioequivalence-guidance