Industria1 de septiembre, 2020
Kymriah, de Novartis, demuestra beneficio clínico en linfoma folicular
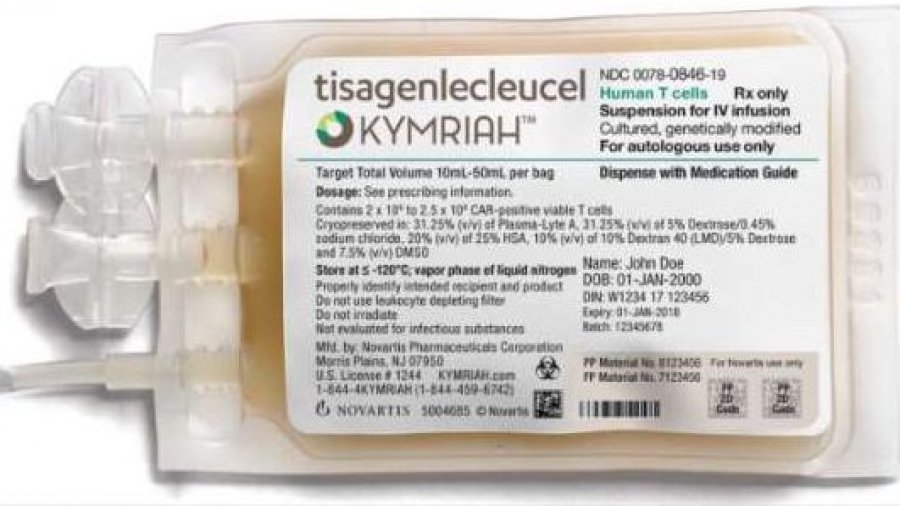
Es la primera terapia con células T CAR aprobada por la FDA, y la primera CAR-T aprobada en dos indicaciones distintas.
NOTICIAS RELACIONADAS
Novartis impulsa una jornada para poner rumbo hacia la medicina del futuro
Clausura del III curso Participación Ciudadana en la Toma de Decisiones en Salud
Novartis ha anunciado resultados positivos del ensayo ELARA de Fase II de Kymriah® (tisagenlecleucel) en pacientes con linfoma folicular (LF) en recaída o refractario (r/r)=. En el análisis intermedio, el estudio global alcanzó su objetivo primario de tasa de respuesta completa (TRC), según la evaluación de un comité de revisión independiente. La TRC es una medida estándar de la respuesta del paciente a la terapia en LF. No se observaron nuevas señales de seguridad de Kymriah=. Los resultados del ensayo ELARA se presentarán en una próxima reunión médica y se incluirán en las presentaciones regulatorias de EE. UU. y la UE.
El linfoma folicular, la segunda forma más común de linfoma no Hodgkin (LNH), es un linfoma indolente y representa aproximadamente el 22% de los casos de LNH. A pesar de los nuevos tratamientos que mejoran la supervivencia global, el LF se considera una neoplasia maligna incurable con un patrón recurrente y remitente. Un paciente diagnosticado de LF recurrente, a lo largo de su vida puede recibir una mediana de cinco líneas de tratamiento previo, con un rango superior de hasta 12 líneas.
Kymriah fue la primera terapia con células T CAR aprobada por la FDA, y la primera CAR-T aprobada en dos indicaciones distintas. Es un tratamiento de una única administración diseñado para potenciar el sistema inmunitario de los pacientes y combatir así su cáncer. Kymriah está aprobado actualmente para el tratamiento de la leucemia linfoblástica aguda (LLA) en pacientes pediátricos y adultos jóvenes (hasta 25 años de edad) y el linfoma difuso de células B grande (LDCBG) r/r en adultos 1.
John Tsai, MD, director de Desarrollo Global de Medicamentos y director Médico de Novartis, ha explicado que "nos complace que Kymriah esté mostrando resultados significativos y pueda proporcionar una opción de tratamiento potencialmente definitiva para pacientes con linfoma folicular en recaída o refractario. Estos resultados respaldan aún más nuestros esfuerzos para reimaginar la medicina en esta neoplasia maligna incurable y para alcanzar a esta población de pacientes desatendidos, que históricamente se han visto sobrecargados por varios años de tratamientos diversos".
Kymriah se desarrolló en colaboración con la Escuela de Medicina Perelman en la Universidad de Pensilvania, una alianza estratégica entre la industria y la academia que fue la primera de su tipo en investigación y desarrollo de CAR-T. Actualmente, Kymriah está aprobado para su uso en al menos una indicación en más de 25 países y en más de 250 centros de tratamiento certificados, con la ambición de una mayor expansión para ayudar a cumplir el objetivo final de llevar la terapia con células T CAR a cada paciente que lo necesite. Mientras Novartis se prepara para el lanzamiento de una posible tercera indicación para Kymriah, la capacidad de fabricación continúa aumentando.